联系人:陈飞
联系电话:020-87560209
传真:
移动电话:13066324063
地址:广州市天河区珠村东横三路8号广桥工业园A栋105房
Email:gzfd2006@163.com
邮编:510660


联系人:陈飞
联系电话:020-87560209
传真:
移动电话:13066324063
地址:广州市天河区珠村东横三路8号广桥工业园A栋105房
Email:gzfd2006@163.com
邮编:510660
与qPCR 相比,数字PCR具有多项优势:
1.在定量检测中,qPCR需要依赖标准曲线和参考品,dPCR无需依赖标准曲线和参考品,可直接进度定量检测,并且定量精度极高,可以达到±2%-±10%的水平,而qPCR通常只能达到±50%左右的精度。
2.对于稀有突变检测,在 qPCR 中,由于大量野生型DNA分子和少量突变型 DNA分子在同一反应体积内竞争结合引物,影响了稀有突变的检测。相比之下,dPCR将 DNA分子分散到多个独立的反应中,每个反应通常只包含少数几个分子。这种分配减少了竞争,提高了检测低丰度突变的准确性,可以将突变灵敏度从1%的水平提高到0.1%甚至0.01%的水平。
3.另一个不同点在于,在qPCR中,抑制剂会导致循环阈值(Ct)发生变化,影响结果。而在dPCR中,即使 PCR 效率下降,只要阴阳性液滴可以区分,定量分析就不会受到影响。这使得dPCR对 PCR 抑制剂的抵抗力更强,对于血液样本,环境 DNA或废水等复杂样本尤为重要。
4.由于数字 PCR能够同时运行多达200,00个反应,因此提高了精确度、灵敏度和重现性。SCI Digital PRO的自动化上样和分液的全自动,与qPCR及其它产品相比相比,还减少了不同操作员和实验室进行实验时的变异性。
5.可以研究表达量变化较低的基因差异,比如在常规的RNA-Seq测试后,会采用qPCR进行结果的复核,对于表达量变化差异较小的基因,其一致性较差,这时dPCR可以带来更高的精度,区分更小差异的变化。
n 数字 PCR 中使用的耗材比实时qPCR 略贵。但是,如果考虑到技术重复性,应比较两到三个 qPCR 反应与一个dPCR 反应的成本。
n 此外,dPCR 比qPCR更容易进行多重检测,当每孔分析更多目标时,还可以降低成本。因此,在某些情况下,dPCR实际上比qPCR 更便宜。
n SCI Digital PRO的超多重检测技术,可以实现在单个芯片内达到同时检测多达15重以上的核酸定量,更大大降低了实验成本。
1.dPCR 中的引物探针设计指南与 qPCR 几乎相同,这使得从 qPCR 检测转移到dPCR设置变得非常简单。
2.在小海龟科技SCI Digital PRO等数字PCR平台上,qPCR试剂兼容性非常好;如果出现部分体系无法兼容时,还可以添加促进剂进行改进。
3.当然,dPCR本身在探针设计上和qPCR也有一些差异之处,比如,qPCR更看重其扩增和剪切效率,而dPCR则更看重其特异性。
dPCR相比qPCR,具有高精度的定量检测能力,dPCR的精度范围一般是±10%(拷贝数),而qPCR的精度范围一般是±5%(Ct值);经过单位归一化之后,dPCR精度比qPCR高出约8倍。
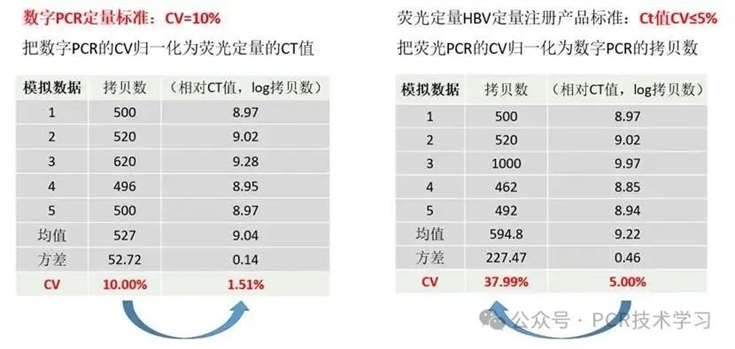
图1 dPCR和qPCR精度差异比较
1.在数字 PCR 中,测量的是单个分子,因此最小输入量的问题不仅涉及质量,还涉及分子数量。理论上,单个分子是可以检测到的,但在实际操作中,由于浓度极低,随机因素对是否能捕获该分子有显著影响。通常情况下,大多数检测方法和样本基质的检测限在3 到 10 个分子之间。
2.在数字 PCR 中,由于液滴数目的有限性,上样量过多会导致所有液滴全部为阳性,这时只能进行定性检测,失去了定量检测的作用。一般2万个液滴的芯片,最高浓度的最大上样量在6万拷贝/反应,也就是终浓度2000拷贝/μL。
数字PCR芯片在上样后会进行油封,一般不会发生污染。通常情况下,按照良好的实验室规范操作,污染的风险极低。自动化的核酸提取仪器,更容易导致污染的发生。
1.使用标准化和验证的方法提取 DNA 和 RNA,因为遗传物质的质量会显著影响 PCR 结果的准确性。
2.阳性对照对于验证检测性能和确认检测是否正常运行至关重要,通过提供一个己知的目标来产生可预测的结果。
3.为了验证您的检测方法,您应该对已知样本进行稀释曲线分析,以确保未来测量的准确性。
4.为了确保您的 dPCR 检测的可靠性和重现性,还应建立:
n 空白限度-可与背景噪声区分开来的最低可检测信号
n 检测限-可靠检测的最小DNA量
n 定量限-能够准确定量评估的最低DNA量
确定检测限(LOD)涉及不同的方法,常用的方法是将 LOD 定义为 LOD 95%,即目标在95% 的概率内可被检测到。例如,如果模板稀释至每微升 0.2 个拷贝,相当于每个芯片中有6个分子,在 21 次测试中可能有 20 次可以检测到,这代表了 95% 的检出率(LOD 95)。如果量减半至每个芯片有3个拷贝,检出率可能会降至90%,表明 LOD 为 90,而不是 95%。通常情况下会选择95%作为检测限标准。
1.大多数人进行技术重复是为了提高精度或确保移液操作正确。第一个理由不适用于 dPCR,因为SCI Digital PRO的测量精度高于大多数移液器的工作精度,因此使用重复并不能提高精度或准确性。第二个理由的重复还是有意义的,因为 qPCR 和 dPCR 的移液操作几乎相同。
2.为了确保结果的准确性和可靠性,阴阳性对照还是必要的;
n 理想情况下,建议运行一个阴性对照,以确保监控环境污染和体系污染(即孔中的阳性分区非常低或没有)。阴性对照的选择尽量采用接近样本的模板,例如,在处理细胞时,使用不表达目的基因的细胞裂解液作为阴性对照比纯水更好。
n 在验证检测方法时,已知的阳性对照,对于确定检测特异性非常有用。
在一维散点图中,每个液滴或腔室的荧光信号,都用一个点表示,横坐标表示液滴的序号,纵坐标表示液滴的荧光强度值。通常情况下,如果1个或多个目标模板 DNA 分子存在于某个液滴中,并实现了PCR扩增时,就会产生荧光信号(基于探针或EvaGreen染料)。通常,一个有阳性模板样本的结果,会在散点图上看到两个聚类的信号层,上面的聚类的是阳性(含有1个或多个分子),下面的聚类为阴性(不含分子)。系统软件或用户手动设置两个聚类之间的阈值,以确定哪些液滴为阳性,哪些为阴性。然后使用泊松公式计算,以确定样品中的分子数量。
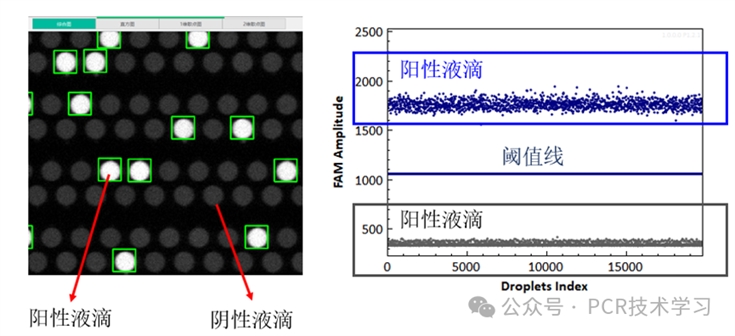
图2 数字PCR扩增后的荧光图像和散点图
不确定度(%)是一个基于泊松分布计算出的统计值,是精密度的一种表现形式,数值越大,结果精度约低。这个值主要受阳性液滴数的影响,主要用于指示样本的浓度是否处于适合合适的 dPCR 的精确定量范围内。如果不确定度(%)为 10% 或更低,则无需调整。如果置信区间较高,则最好根据情况使用稍多(通常需要提高浓度)或稍少的 DNA。
当样本浓度本身就较低时,不确定度(%)无法达到10%以下时,是否表示结果不可靠呢?不是的!
这致意味着你的结果在 10%的精度下略显不可靠。换句话说,当你在较低拷贝数时,测量样本之间的微小差异会变得更加困难。请注意即使在这些阶段精度较低,dPCR仍然比其他分子技术如 qPCR 更可靠。
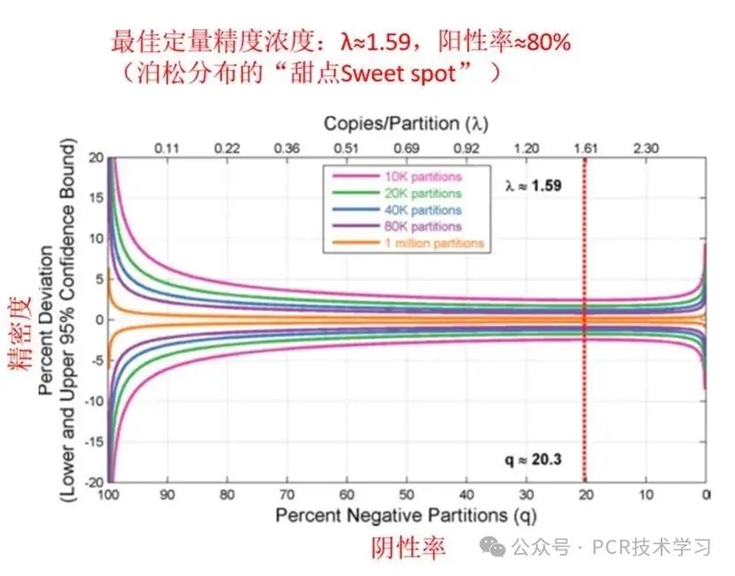
图3 精密度(不确定度)和阳性率/阴性率关系
dPCR 中进行定量的统计学公式是泊松分布,基于将阴性或阳性液滴的比例,而这一判断则由液滴的荧光信号强度决定。SCI Digital PRO软件会自动设置某个阈值,但也可以手动调整。尤其是,对于全阴性或全阳性样本时,软件无法预先判断改归为阴性或是阳性。
这种手动调整非常灵活,您可以随意设定。虽然感觉有些随意,但实际上与流式细胞术、qPCR 或凝胶电泳分析时设置阈值几乎没有区别。同样地,NGS也依赖于指标来确定一定数量的reads为真实的reads或噪声。
SCI Digital PRO对阈值提供了一个特殊的功能,如果是已经开发成熟的试剂盒,可以根据前期经验进行阈值的预设,这样会避免对于全阴性或全阳性样本的自动阈值生成时的偏差,更利于临床检测的自动化。
1.在数字 PCR 数据中,正负结果之间的清晰分离(信噪比)至关重要。这里“雨点”指的是那些既不明显呈阳性也不明显呈阴性的中间部分,这些“雨点”的存在会导致阈值的难以界定。这些“雨点”信号受到 PCR 效率、PCR 抑制剂的存在以及非靶向结合等因素的影响。
PCR 参数的调整有助于解决这些“雨点”。例如:
n 提高退火温度以减少脱靶结合并明确正负信号之间的分离,这种方法有助于确定“雨点”分区是由于效率降低还是脱靶效应。
n 优化引物和探针浓度
n 调整 PCR 循环次数
n 调整退火和延伸时间
2.如果上述方案仍旧无法接近,需要考虑重新设计更合适的引物或探针,以及更换适合的检测体系(酶或buffer)
3.特别强调的是,针对环状质粒DNA,需要进行酶切线性化处理;否则,很容易出现“雨点”现象!(超螺旋,解链难度大)
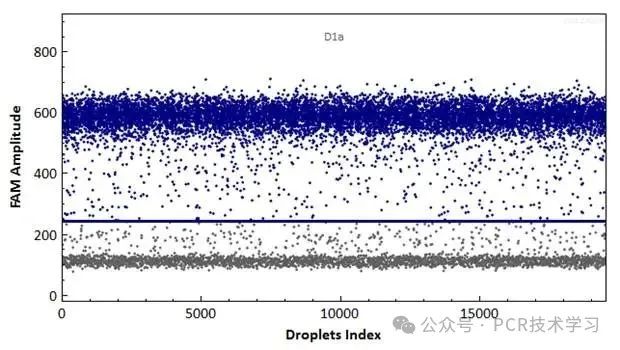
图4 数字PCR“雨点”现象示例
这可能意味着存在非特异性扩增。如果你的 NTC是干净的,你可以尝试提高退火温度以使反应更加严格。如果在多重检测过程中观察到这种情况,则不会影响目标的浓度或丰度。
过度饱和是由于样本过载引起的,表现为仅存在正向分区。在这种情况下,定量不再准确,因为dPCR 中使用的统计模型假设随机分布,这需要一定数量的分区为空。
为了避免未知浓度样品过饱和,可以先进行系列稀释,观察在哪个稀释度下获得最佳信噪比。如果采用多重检测,建议先单独优化每个目标(单重检测),然后再逐个进行多重检测(双重、三重等)
在进行多重检测时,首先采用不同的荧光通道去标记不同靶点探针:
以下是设计多重检测的几个提示:
1.设计引物探针时需要进行多重比对分析;
2. 选择具有相似 PCR 条件的引物探针;
3. 模板 (C)DNA 中具有相似浓度的多重靶标;
4. 减少模板量可以减少检测之间的干扰;
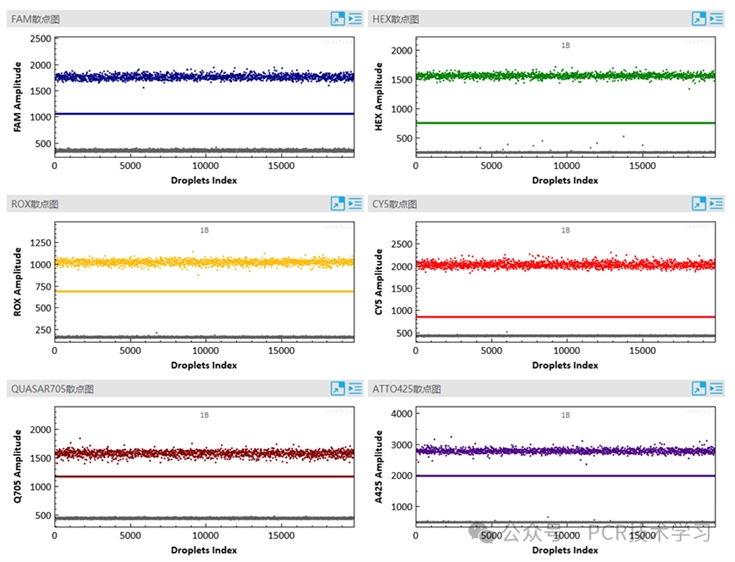
图5 SCI Digital PRO六色荧光多重实例
5. 使用 2:1 的引物和探针比例
建议选择800 nM引物和 400 nM探针用于单重检测,如果您需要检测双重检测以上,可以尝试降低浓度
SCI Dgital PRO具有两个不同的温扩模块,两个模块可以进行独立控制,设置不同的温扩程序;
SCI Digital PRO的每一个独立模块,还可以设置温度梯度功能,可以运行温度梯度程序,温度从左到右的6个位置可以具有不同的温度。
SCI Digital PRO仪器具有FAM(VIC)、HEX、ROX、Cy5、Q705、Atto425等荧光通道,相关波长的探针均可使用;
还可使用EvaGreen和PicoGreen染料;染料法无法实现多重检测,且对引物的特异性要求更高!
SCI Digital PRO dPCR 具有配套的经过优化后的通用预混液和酶。大部分客户的通用体系也可以使用,少量客户的体系可能兼容性不好(可以增加促进剂改善);建议优选SCI Digital PRO dPCR配套的试剂盒。
通常,使用相似浓度的 DNA有助于样本之间的比较。然而,在处理珍贵的 DNA样本时,最好省略这一步骤。
虽然 WGS 涉及对整个 DNA 进行测序而不使用特定引物,但 dPCR 需要针对已知目标设计的引物和探针。数字 PCR 在 WGS 研究中特别有用,可以进一步调査研究过程中确定的具体目标。通过设计特定的引物和探针,研究人员可以利用 dPCR 验证并量化 WGS 研究的结果。此外,dPCR 有助于准确量化用于测序的文库,这可以通过减少文库的质量问题来降低成本。
dPCR 对于低浓度样本的精确定量对于表观遗传学研究非常有利,因为不太敏感的方法很容易错过表观遗传变化的低水平表达检测。
22. 如何用 dPCR 检测拷贝数变异(CNV)?
对于 CNV 检测,工作流程与 qPCR 非常相似。通常情况下,分别检测目标基因和内参基因。当然,也可以把内参可目标基因放在一个体系内同时检测。然后,根据目标基因和内参基因拷贝数直接进行计算即可。特别注意的是,dPCR相比于qPCR,检测定量动态范围较小,内参基因和目标基因的表达差异不易过大,大部分高表达的qPCR内参在dPCR中进行低表达量基因的检测时不太适用(除非分开检测,进行不同比例的稀释)。
23. 如何用 dPCR 定量囊泡和血浆中的 miRNA ?
数字 PCR 可用于量化囊泡和血浆样本中的 miRNA。由于 miRNA 的表达量相对较低,尤其是在血浆中,dPCR 提供了高灵敏度和精确度,能够检测低水平的 miRNA 并监测其进展。miRNA的检测,需要特别注意其样本提取和体系设计,尤其是引物的特异性至关重要。
24. dPCR 在传染病中的应用?
dPCR 可用于感染疾病的研究。尤其是对于血液中的病原体感染,dPCR具有较大的优势;小海龟科技开发的SCI Digital PRO数字PCR系统,不仅可以实现多重的病原体检测,还可以实现超多重的病原体检测,通过多色荧光编解码技术,实现在1张芯片,1个反应内检测超过15种不同的病原体或耐药基因型。
25. dPCR 在污水分析中的灵敏度、抑制效应和成本效益?
dPCR在污水病原体检测和回溯的研究中,通常,其检测限与 qPCR 相比更优,检测限则在5到10分子之间。在 PCR 抑制方面,dPCR的抑制问题明显较少。
在许多情况下,dPCR 所需的重复次数比 qPCR 少,所以即使每个反应的成本在 dPCR 中更高,但总成本可能不会像 qPCR 那样高。
dPCR可用于许多涉及环境 DNA 的项目,包括水质监测、土壤微生物测量或从水样中追踪海洋生物。dPCR 在这里的优势在于更高的灵敏度和对抑制剂的耐受性。SCI Digital PRO在处理复杂样本基质时表现非常出色,在长江江豚eDNA检测中具有非常好的效果。
在细胞和基因治疗领域中,dPCR的应用非常广泛。包括生产携带基因或细胞的生物基质,在生产过程中的许多步骤中,数字 PCR 可以用来控制产品质量。其他新兴领域还包括基于污水的流行病学检测和食品病原体的定量检测(如奶粉,益生菌,海洋水产品等)。
此外,很多基于 PCR的应用,如临床检测,尤其是在肿瘤学领域,最终可能会转向 dPCR。

扫描关注,“广州飞迪”官方微信公众号
